びまん性大細胞型B細胞
リンパ腫(DLBCL)
JULIET試験
再発⼜は難治性のDLBCL患者を対象とした国際共同第Ⅱ相試験(C2201試験、JULIET試験)(日本人を含む)
Schuster, SJ. et al.:N. Engl. J. Med. 380(1), 45, 2019 COI:本試験はノバルティスの資⾦により⾏われた。著者にノバルティスより謝礼、研究助成⾦を受領した者及び社員が含まれる。
社内資料:再発又は難治性のびまん性大細胞型B細胞リンパ腫 (DLBCL)成人患者を対象とするCTL019の有効性及び安全性を評価する第Ⅱ相単群多施設試験(C2201試験)(承認時評価資料)
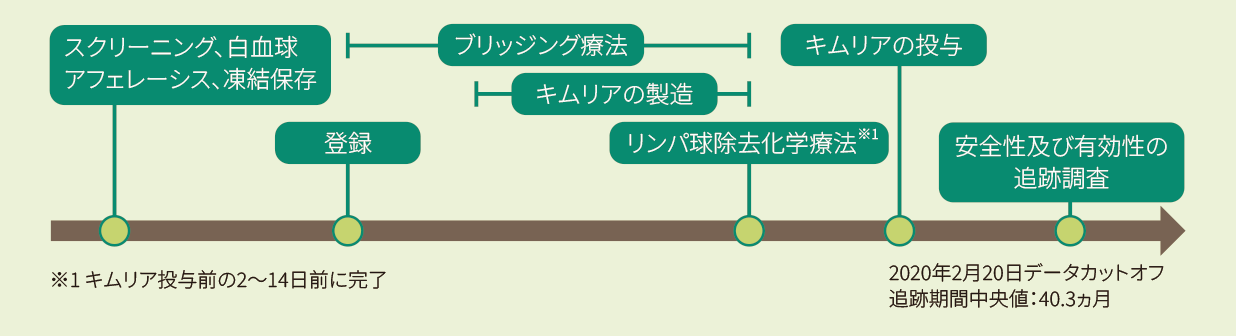
再発⼜は難治性のDLBCL患者を対象にキムリアの有効性及び安全性を評価する、単群、多施設共同、第Ⅱ相試験(C2201試験、JULIET試験)
試験デザイン
- 目的
-
再発又は難治性のDLBCL患者を対象に、キムリアの有効性及び安全性を検討する。
- 対象
-
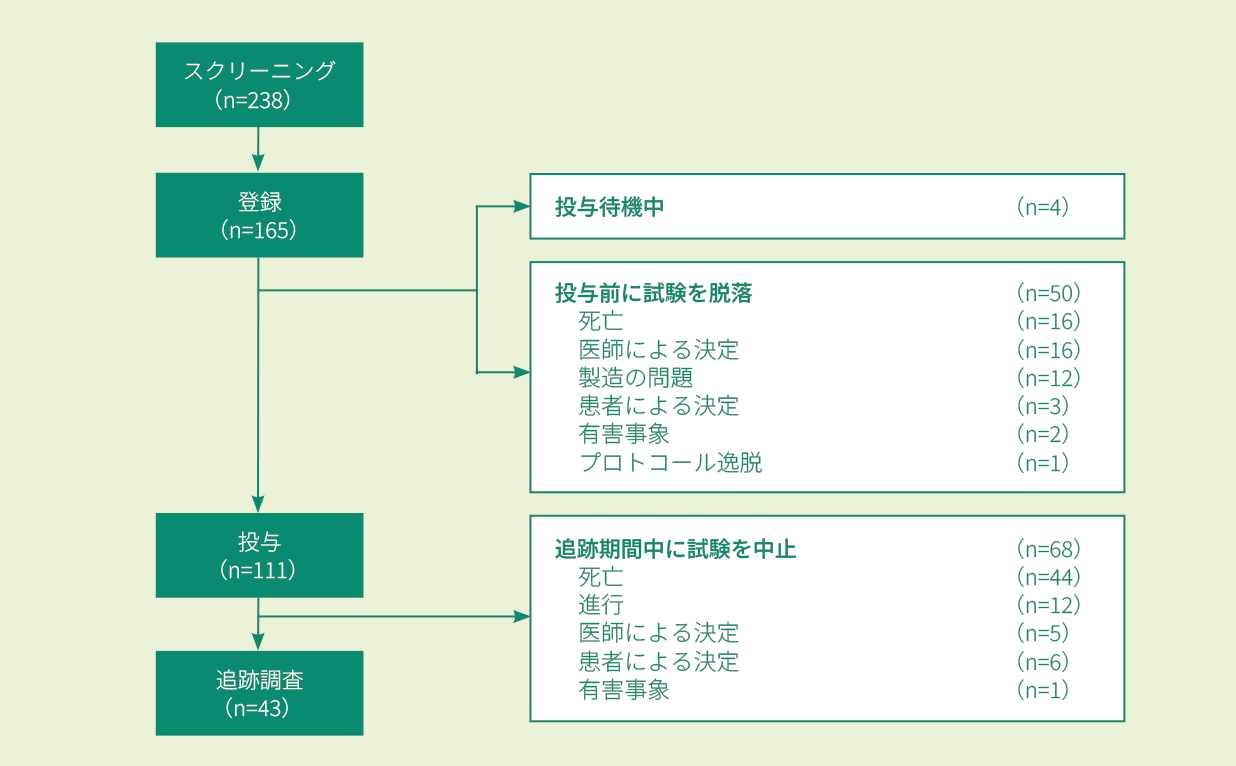
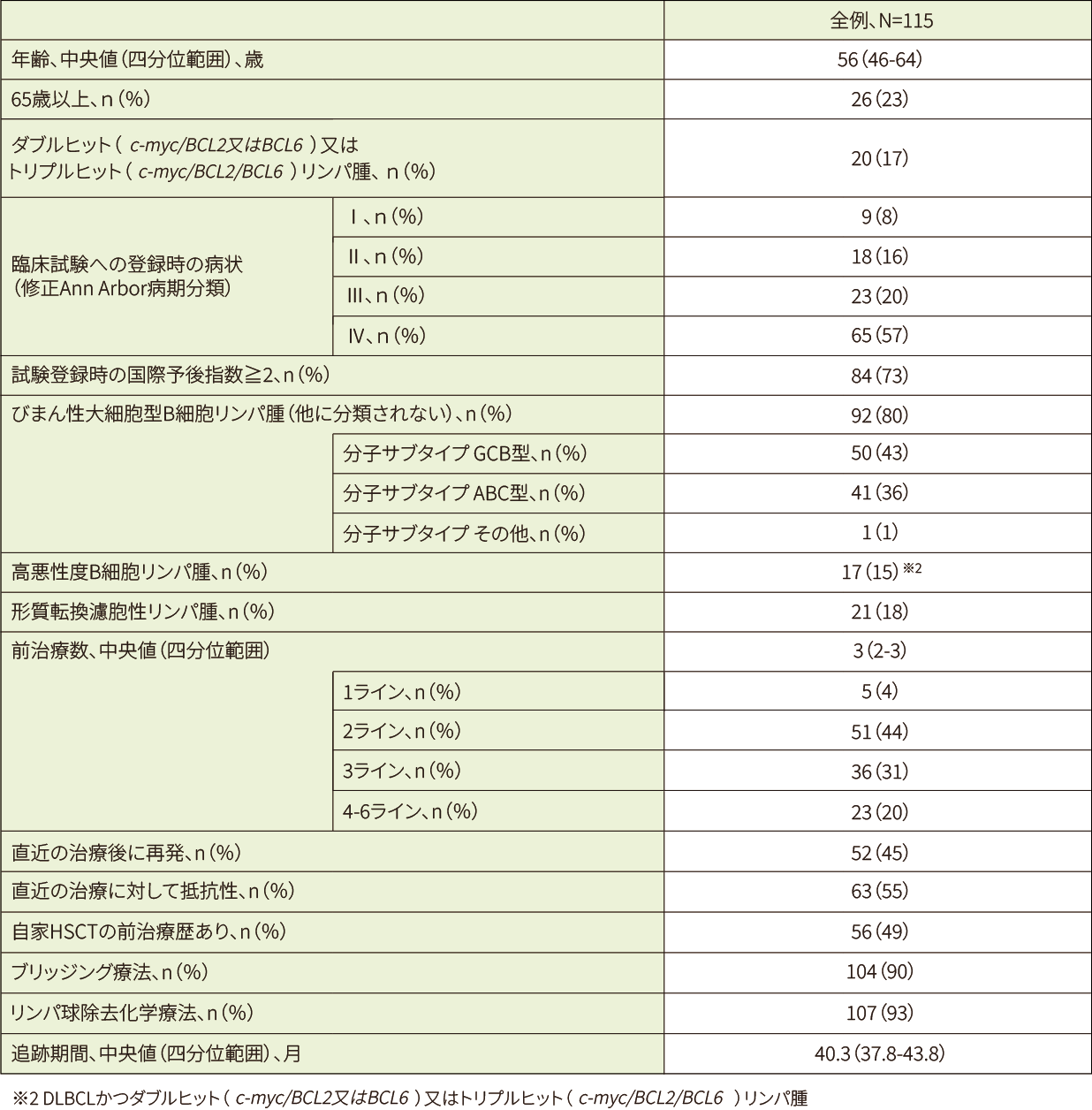
2ライン**以上の化学療法[リツキシマブ(遺伝子組換え)及びアントラサイクリン系抗悪性腫瘍剤を含む]を受けたが再発又は難治性であり、かつ自家HSCT施行後に再発した又は自家HSCTの適応とならないDLBCL患者238例(スクリーニング時)のうち投与例111例(日本人5例を含む)。なお、悪性腫瘍(リンパ腫)の活動性の中枢神経系浸潤のある患者は除外された。
**救援化学療法後に自家HSCT併用大量化学療法を行った場合、1ラインとした。
- 投与方法・投与量
-
CAR発現生T細胞として5.0×108個(用量許容範囲1.0×108〜5.0×108個、体重に関係なく)を単回静脈内投与した。
- 評価項目・
解析計画 -
- 主要評価項目
-
キムリアの投与を受けた主要コホートの患者における奏効率(ORR)[最良総合効果が完全奏効(CR)又は部分奏効(PR)であった患者の割合]:米国の製造施設で製造されたキムリアの投与を受けた患者を対象とし、効果判定にはLugano分類による独立審査委員会(IRC)判定を用いた。
- 副次評価項目
-
安全性、細胞動態、奏効期間、全生存期間等
ORR及び奏効期間に関しては、年齢、性別、人種、民族及び予後にかかわる要因(国際予後指標、前治療のライン数、試験登録時の病期、HSCT治療歴、再発又は難治性、分子サブタイプ、転座等)に対して部分集団解析を実施した。
- コホート
-
以下の2つのコホートを設定した。
主要コホート:米国の製造施設で製造されたキムリアを投与する。
コホートA:欧州の製造施設で製造されたキムリアを投与する。
- 解析計画
-
主要評価項目(キムリアの投与を受けた主要コホートの患者におけるORR)は、中間解析と主解析の2回の解析を伴う群逐次デザインのもと、全体の有意水準を片側2.5%として検定を行う計画とした(帰無仮説:p≦20%、対立仮説:p>20%)。中間解析時に帰無仮説は棄却され、主要目的を達成した。そのため、本試験のアップデート解析(主解析以降に実施)の成績では、推論的解釈を伴う正式な仮説検定は行わず、同じ仮説に基づく名目のp値と正確な両側95%CIを提示した。
副次評価項目は、記述的な解析とし、要約統計量を適宜算出した。イベント発現までの期間に関する評価項目はKaplan-Meier法を用いて解析し、Kaplan-Meier曲線、期間の中央値、ある特定の時点でイベントが発現していない確率を適宜提示した。また、主要評価項目について部分集団解析を実施した。
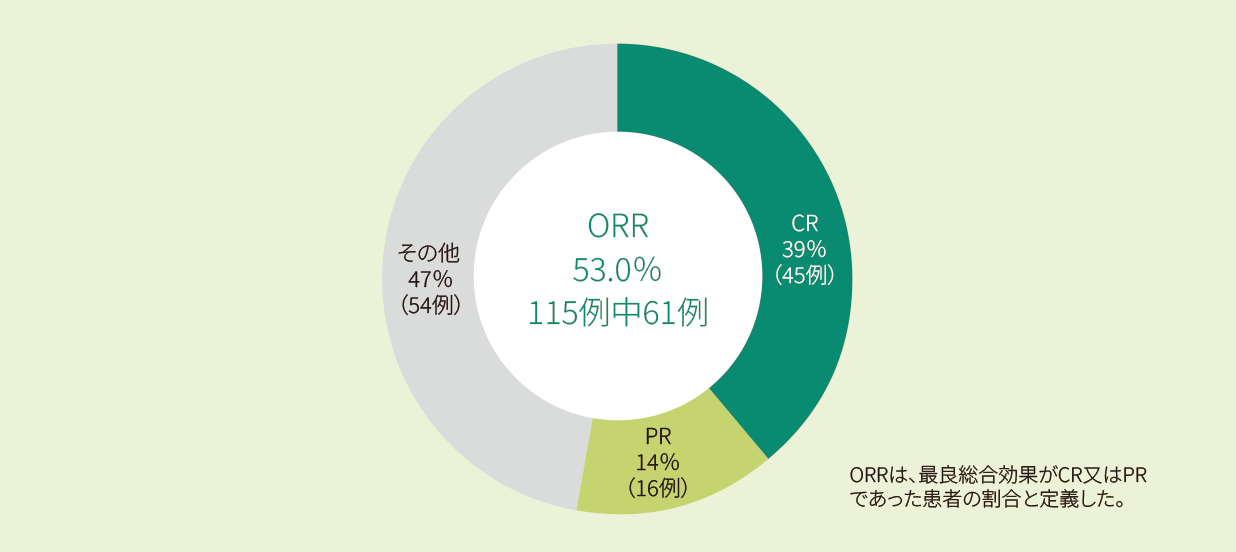
キムリア投与後のORRは52%であり、その内訳はCRが40%、PRが12%でした<主要評価項目>
投与後のORR(IRC判定、主要コホートEAS)
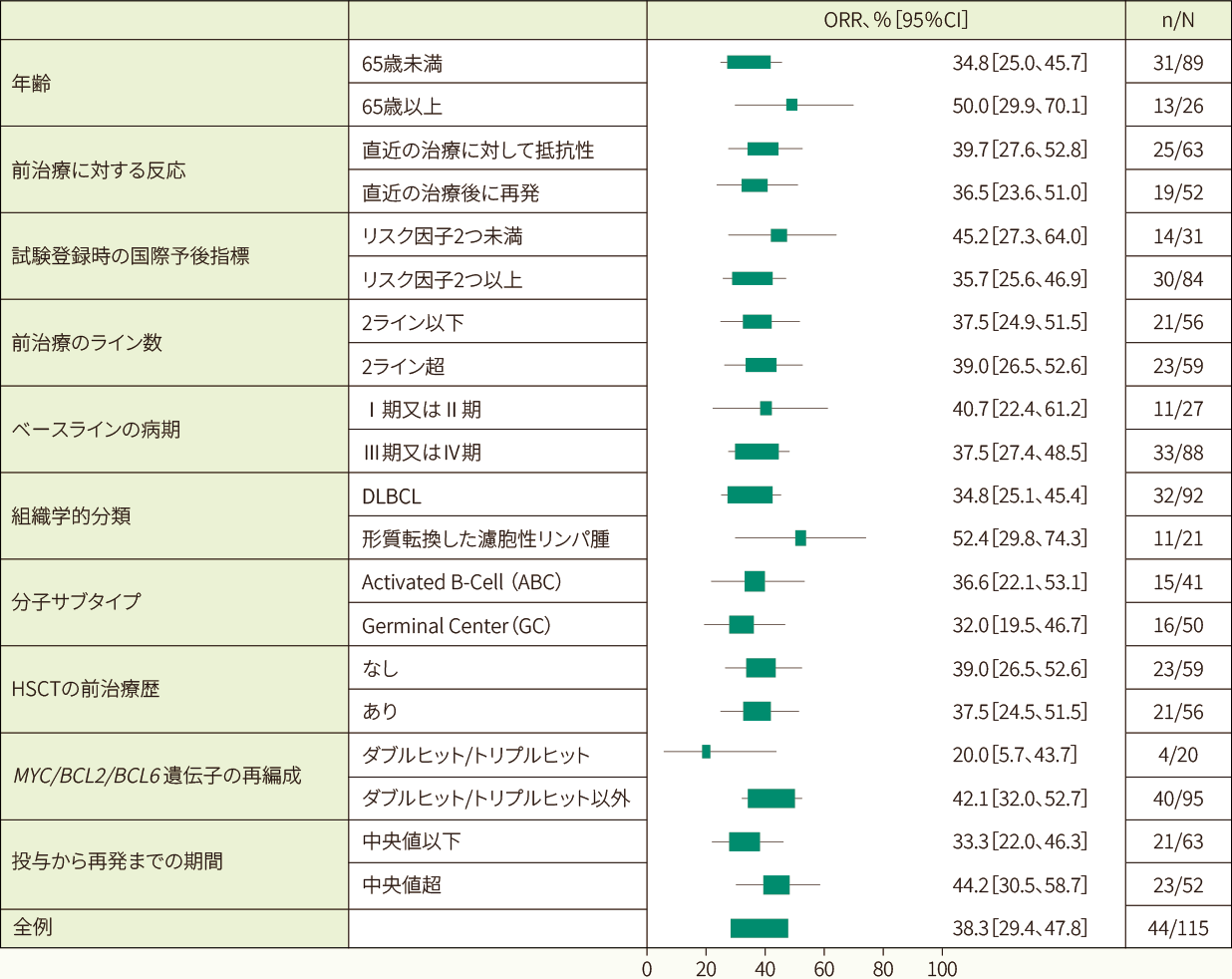
前治療のライン数、自家造血幹細胞移植歴、分子サブタイプ等によらず、いずれの部分集団においても一貫したORRが得られました<部分集団解析>
主要コホートにおけるORRの部分集団解析(IRC判定、EAS)
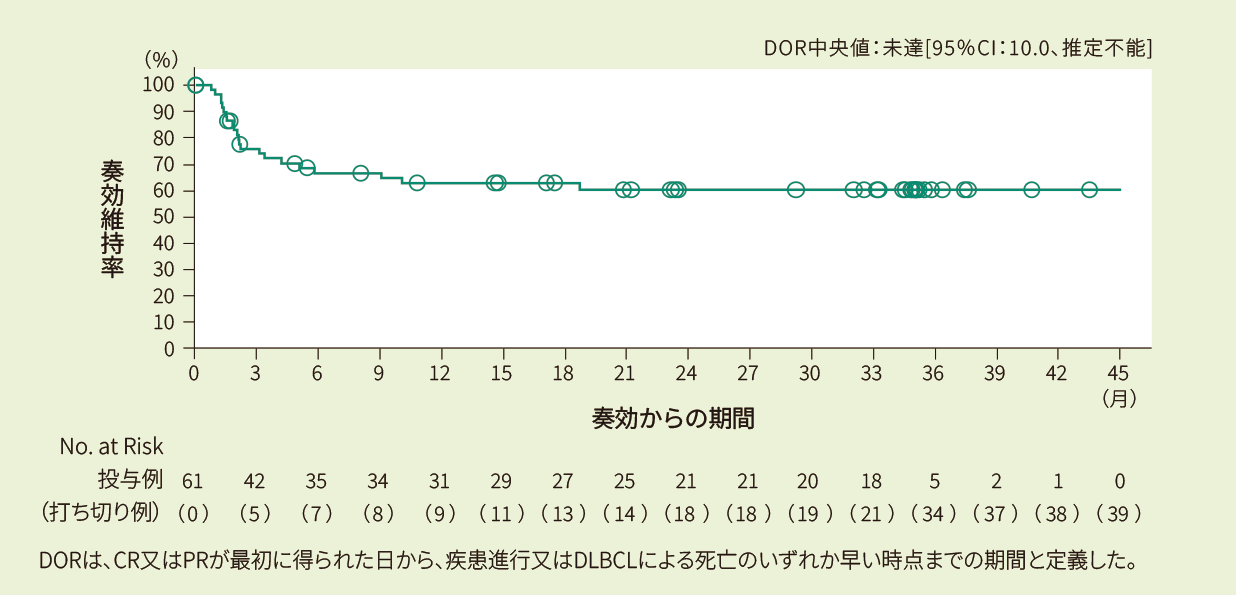
奏効例48例における6ヵ月時点の奏効維持率は68%、12ヵ月時点の奏効維持率は65%であり、奏効期間の中央値は未達でした<副次評価項目(部分集団解析)>
Kaplan-Meier法で推定したIRC判定に基づく奏効期間の曲線(EAS)
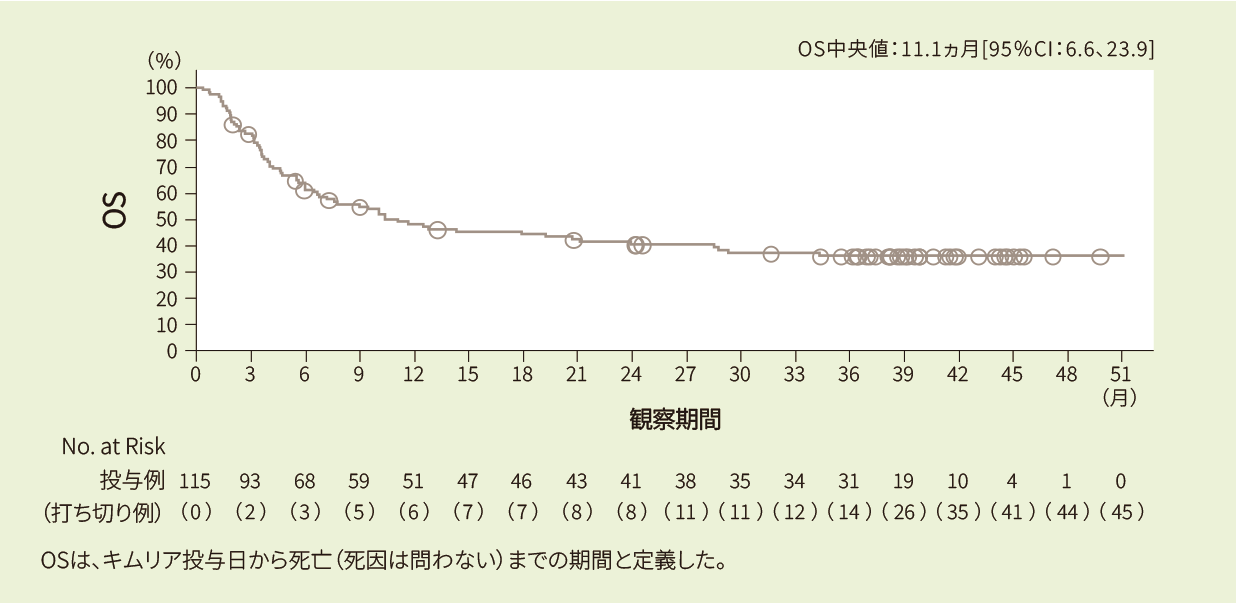
投与例111例における6ヵ月時点の全生存率は62%、12ヵ月時点の全生存率は49%であり、全生存期間の中央値は12ヵ月でした<副次評価項目>
Kaplan-Meier法で推定したIRC判定に基づく全⽣存期間の曲線(FAS)
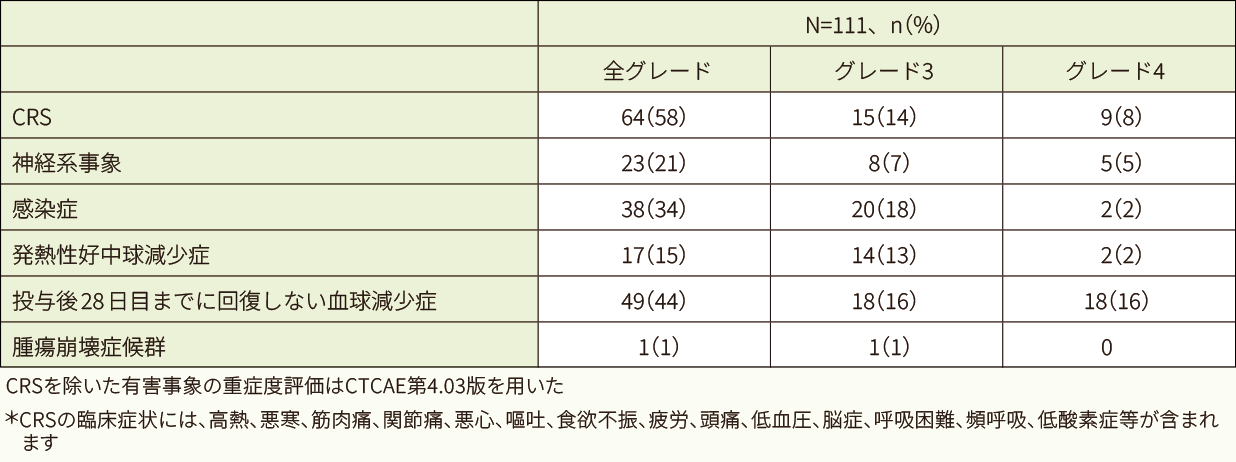
データカットオフ日(2017年12月)時点では、安全性解析対象111例中99例(89%)に副作用が認められました。高頻度(20%超)に認められた副作用は、サイトカイン放出症候群(CRS*)(58%)、発熱(25%)及び低血圧(21%)でした。高頻度(5%超)に認められたグレード4の副作用は、好中球数減少16例(14%)、血小板数減少12例(11%)、CRS 9例(8%)及び白血球数減少10例(9%)でした。
データカットオフ日(2017年12月)時点では、有害事象は111例全例に認められ、25%以上に認められた全グレードの有害事象は、CRS 64例(58%)、貧血53例(48%)、発熱39例(35%)、好中球数減少38例(34%)、血小板数減少及び白血球数減少 各37例(33%)、下痢35例(32%)、悪心32例(29%)、低血圧29例(26%)及び疲労28例(25%)でした。
データカットオフ日(2017年12月)時点では、重篤な有害事象は72例(64.9%)に認められ、3例以上に認められた重篤な有害事象はCRS 30例(27.0%)、発熱性好中球減少症9例(8.1%)、発熱8例(7.2%)、急性腎障害、脳症及び疲労 各4例(3.6%)、クロストリジウム-ディフィシル感染、錯乱状態、呼吸困難、多臓器不全症候群、好中球減少、肺炎 各3例(2.7%)でした。
データカットオフ日(2017年12月)時点では、投与後8週以内で特に注意を要する有害事象は111例中89例(80.2%)に認められ、最も多く認められた有害事象はCRSが64例(58%)でした。CRSの発現までの期間の中央値は3日であり、CRSの持続期間の中央値は7日でした。CRSに対して実施した、主な抗サイトカイン療法はトシリズマブ(17例)、副腎皮質ステロイド剤(12例)の投与等であり、主な支持療法はICUへの入室、酸素吸入(各27例)や高用量の昇圧剤(7例)の投与等でした。神経系事象の多くは、CRSが発現している間又はCRSから回復した直後に認められました。主な神経系事象は、錯乱状態(9%)、脳症(6%)、痙攣発作(5%)等でした。
キムリア投与後8週以内で特に注意を要する有害事象(データカットオフ日:2017年12月)
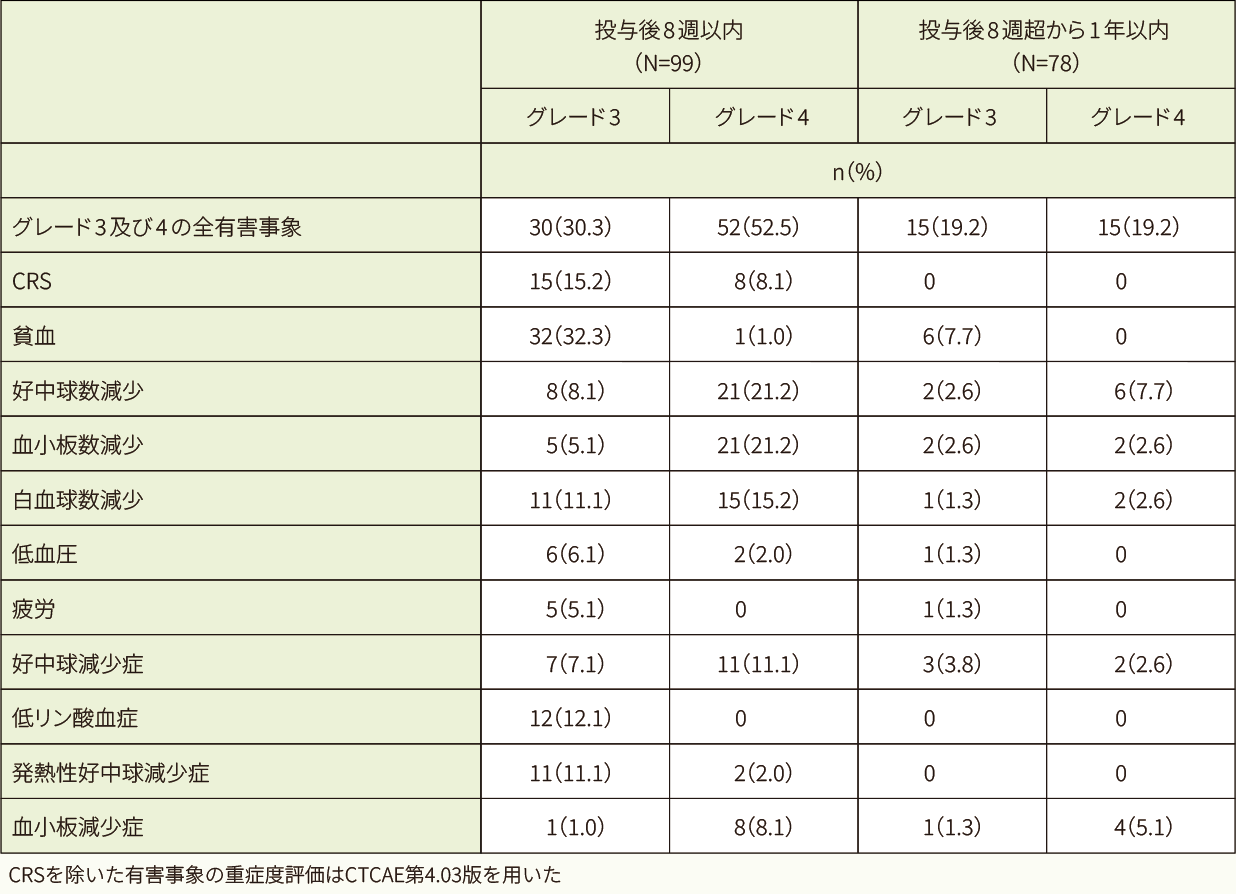
データカットオフ⽇(2017年3⽉)時点では、グレード3及び4の有害事象の多くは、キムリア投与後8週以内に認められました。
発現率5%以上のグレード3及び4の有害事象(データカットオフ日:2017年3月)
データカットオフ日(2017年12月)時点では、投与後8週以内に試験中止に至った有害事象が3例に発現し、その内訳は肺出血、発熱性好中球減少症及び誤嚥性肺炎が各1例でした。肺出血はキムリア及びリンパ球除去化学療法のいずれか又は両方との関連ありと判断され、発熱性好中球減少症及び誤嚥性肺炎はキムリアとの関連を否定されました。
投与後30日以内の死亡は3例に認められ、死因はすべて疾患進行でした。投与後30日超の死亡は50例に認められ、このうち42例が疾患進行により、8例は疾患進行以外の多臓器機能不全症候群(2例)、肺出血、慢性腎臓病、脳出血、出血性十二指腸潰瘍及び敗血症(各1例)により死亡しました。肺出血はキムリア及びリンパ球除去化学療法のいずれか又は両方との関連ありと判断されました。
- 【効能、効果又は性能】
-
1. 再発又は難治性のCD19陽性のB細胞性急性リンパ芽球性白血病。ただし、以下のいずれかの場合であって、CD19抗原を標的としたキメラ抗原受容体発現T細胞輸注療法の治療歴がない患者に限る。
・初発の患者では標準的な化学療法を2回以上施行したが寛解が得られない場合
・再発の患者では化学療法を1回以上施行したが寛解が得られない場合
・同種造血幹細胞移植の適応とならない又は同種造血幹細胞移植後に再発した場合
2. 再発又は難治性のびまん性大細胞型B細胞リンパ腫。ただし、以下のいずれかの場合であって、CD19抗原を標的としたキメラ抗原受容体発現T細胞輸注療法の治療歴がない、かつ、自家造血幹細胞移植の適応とならない又は自家造血幹細胞移植後に再発した患者に限る。
・ 初発の患者では化学療法を2回以上、再発の患者では再発後に化学療法を1回以上施行し、化学療法により完全奏効が得られなかった又は完全奏効が得られたが再発した場合
・ 濾胞性リンパ腫が形質転換した患者では通算2回以上の化学療法を施行し、形質転換後には化学療法を1回以上施行したが、形質転換後の化学療法により完全奏効が得られなかった又は完全奏効が得られたが再発した場合
3. 再発又は難治性の濾胞性リンパ腫。ただし、以下の場合であって、CD19抗原を標的としたキメラ抗原受容体発現T細胞輸注療法の治療歴がない患者に限る。
・ 初発の患者では全身療法を2回以上、再発の患者では再発後に全身療法を1回以上施行し、全身療法により奏効が得られなかった又は奏効が得られたが再発した場合
《効能、効果又は性能に関連する使用上の注意》
1. 再発又は難治性のCD19陽性のB細胞性急性リンパ芽球性白血病
(1)25歳以下(投与時)の患者に使用すること。
(2)フローサイトメトリー法又は免疫組織染色法等により検査を行い、CD19抗原が陽性であることが確認された患者に使用すること。
(3)臨床試験に組み入れられた患者の前治療歴等について、【臨床成績】の項の内容を熟知し、本品の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
2. 再発又は難治性のびまん性大細胞型B細胞リンパ腫、再発又は難治性の濾胞性リンパ腫
(1)臨床試験に組み入れられた患者の組織型、前治療歴等について、【臨床成績】の項の内容を熟知し、本品の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
- CAR:
- chimeric antigen receptor;キメラ抗原受容体
- CR:
- complete response;完全奏効
- CRS:
- cytokine release syndrome;サイトカイン放出症候群
- DLBCL:
- diffuse large B-cell lymphoma;びまん性大細胞型B細胞リンパ腫
- FL:
- follicular lymphoma;濾胞性リンパ腫
- HSCT:
- hematopoietic stem cell transplantation;造血幹細胞移植
- IRC:
- independent review committee;独立審査委員会
- ORR:
- overall response rate;奏効率
- PR:
- partial response;部分奏効