B細胞性急性リンパ芽球性白血病
(B-ALL)
ENSIGN試験
再発又は難治性のCD19陽性のB-ALL又はリンパ芽球性リンパ腫患者を対象とした第Ⅱ相試験(B2205J試験、ENSIGN試験) <海外データ>
社内資料:再発性及び難治性のB細胞性急性リンパ芽球性白血病の小児患者を対象とするCTL019の有効性及び安全性を評価する第Ⅱ相単群多施設試験 (B2205J試験) (承認時評価資料)
小児及び若年成人における再発又は難治性のB-ALL又はB細胞性リンパ芽球性リンパ腫患者を対象にキムリアの有効性及び安全性を評価する、単群、多施設共同、第Ⅱ相試験(B2205J試験)
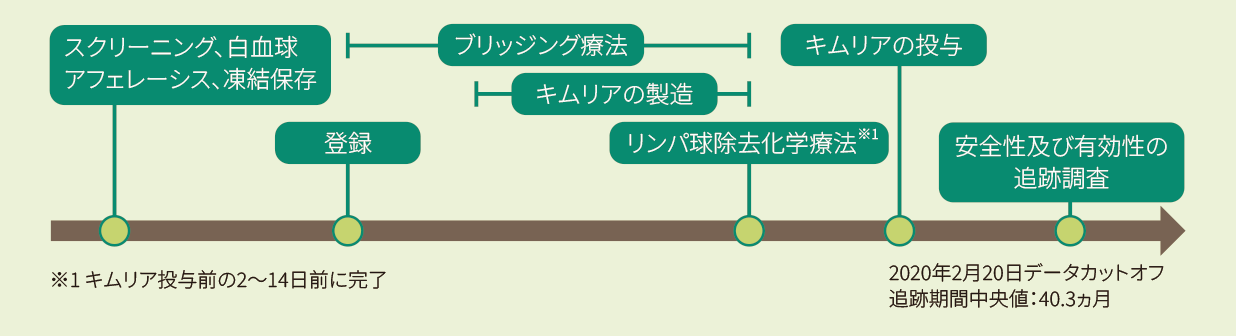
試験デザイン
- 目的
-
再発又は難治性のB-ALL及びB細胞性リンパ芽球性リンパ腫患者を対象に、Penn又はNovartisの製造施設(本項目において以下、すべての製造施設)で製造されたキムリアの有効性及び安全性を検討する。
- 対象
-
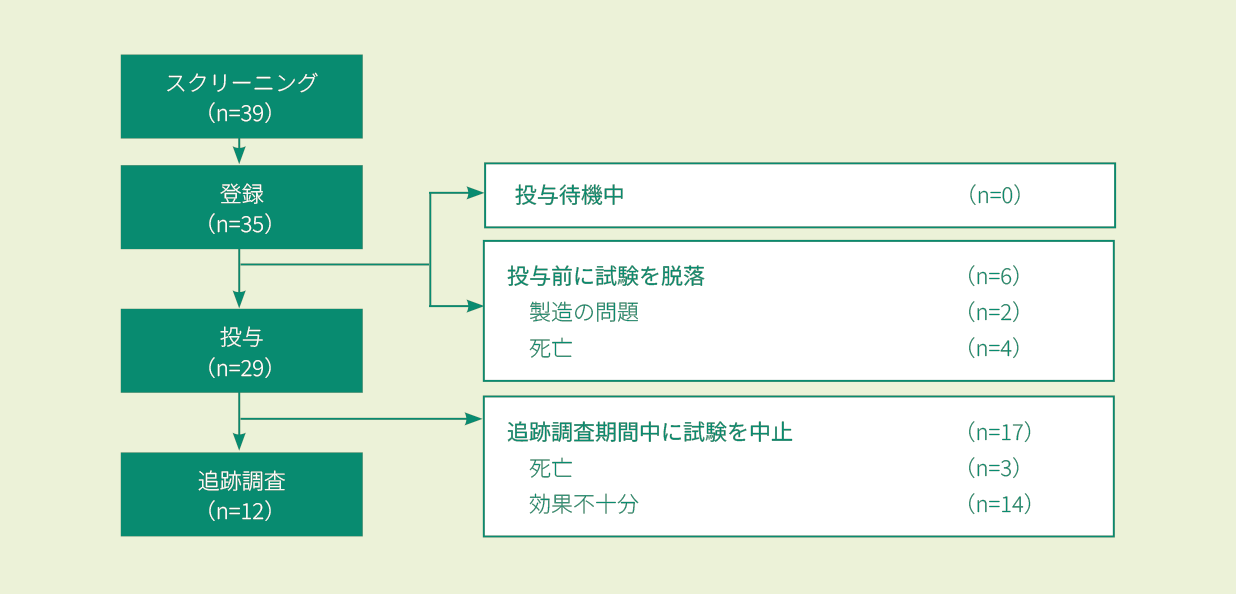
①〜⑤のいずれかに該当する3歳(スクリーニング時)〜21歳以下(B-ALLの初回診断時)の再発又は難治性のB-ALL患者及びB細胞性リンパ芽球性リンパ腫患者注1)39例(スクリーニング時)のうち投与例29例。なお、髄外単独病変の再発は除外された。
①2回以上の骨髄再発が認められた ②同種HSCT後に骨髄再発し、キムリアの投与時点で同種HSCTから6ヵ月以上経過している ③同種HSCTの適応がない ④標準の化学療法レジメンを2サイクル受けた後でも寛解を達成しないと定義される初発難治性、又は再発した白血病に対して標準の化学療法を1サイクル受けた後でも寛解を達成しないと定義される化学療法難治性 ⑤フィラデルフィア染色体陽性の患者の場合には、チロシンキナーゼ阻害剤(TKI)不耐又は禁忌、2種類以上のTKIを受けても奏効が得られない注1) B細胞性リンパ腫患者は登録されなかった
- 投与方法・投与量
-
体重50kg以下の場合には、CAR発現生T細胞として2.0×106~5.0×106個/kg、体重50kg超の場合には、CAR発現生T細胞として1.0×108〜2.5×108個(体重に関係なく)を単回静脈内投与した。
また、他の安全性に関する出荷基準をすべて満たしていれば、以下の範囲での投与も可能とした。- 体重50kg以下の患者では、CAR発現生T細胞として0.2×106~5.0×106個/kg
- 体重50kgを超える患者では、体重を問わずCAR発現生T細胞として0.1×108~2.5×108個
- 評価項目・
解析計画 -
- 主要評価項目
-
すべての製造施設で製造されたキムリアの投与を受けた患者における投与後6ヵ月以内のORR(最良総合効果としてCR又はCRiを達成した患者の割合)とした。B-ALL患者ではIRC判定に基づくORR、B細胞性リンパ芽球性リンパ腫患者では治験責任医師判定に基づくORRとした。解析対象集団はFASとした。
CRは骨髄における芽球割合5%未満、髄外病変のエビデンスなし、輸血なしで末梢血球数の完全回復(血小板数100000/μL超及び好中球の絶対数1000/μL超)と定義し、CRiは骨髄における芽球割合5%未満、髄外病変のエビデンスなし、輸血の有無に関係なく末梢血球数の未回復と定義した。
- 副次評価項目
-
- 安全性、細胞動態
- キムリア投与後6ヵ月時点及び28日時点で骨髄MRD陰性寛解が得られた患者の割合、寛解期間、全生存期間等
- 解析計画
-
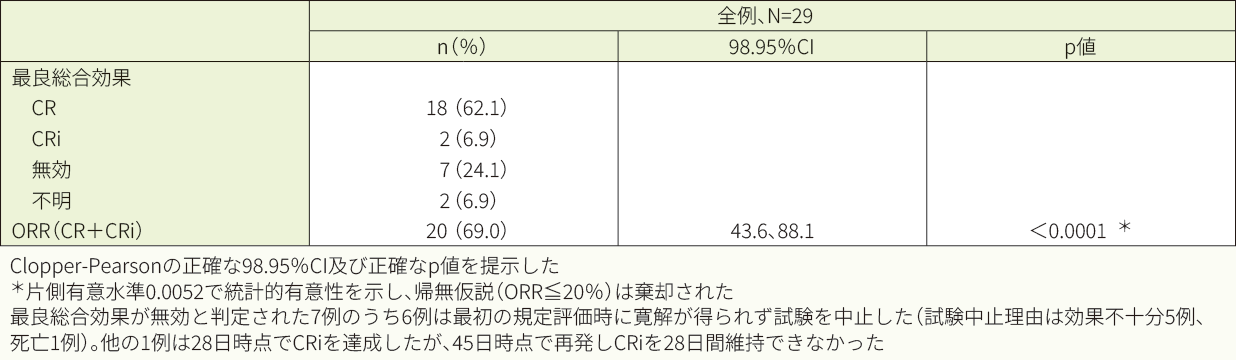
主要評価項目(すべての製造施設で製造されたキムリアの投与を受けた患者における投与後6ヵ月以内のORR)は、中間解析と主解析の2回の解析を伴う群逐次デザインのもと、全体の有意水準を片側2.5%として仮説検定を行う計画とした(帰無仮説:p≦20%、対立仮説:p>20%)。中間解析時に帰無仮説は棄却され、主要目的を達成した。本試験では、中間解析の成績を提示した。
副次評価項目は、記述的な解析とし、要約統計量を適宜算出した。イベント発現までの期間に関する評価項目はKaplan-Meier法を用いて解析し、Kaplan-Meier曲線、期間の中央値、ある特定の時点でイベントが発現していない確率を適宜提示した。
キムリア投与後6ヵ月以内のORRは69.0%でした<主要評価項目>
投与後6ヵ月以内のORR(IRC判定、FAS)
寛解例の90.0%が骨髄MRD陰性の深い寛解を達成しました<副次評価項目>
キムリアの投与を受けた29例中18例(62.1%)が、投与後6ヵ月以内に骨髄MRD陰性(MRD%<0.01%)の寛解を達成しました。投与後6ヵ月以内にCR又はCRiを達成した20例中18例(90.0%)が同時に骨髄MRD陰性も達成しましたが、2例は骨髄MRD陽性(0.01%≦MRD<5%)でした。MRDは中央検査機関で測定されました。
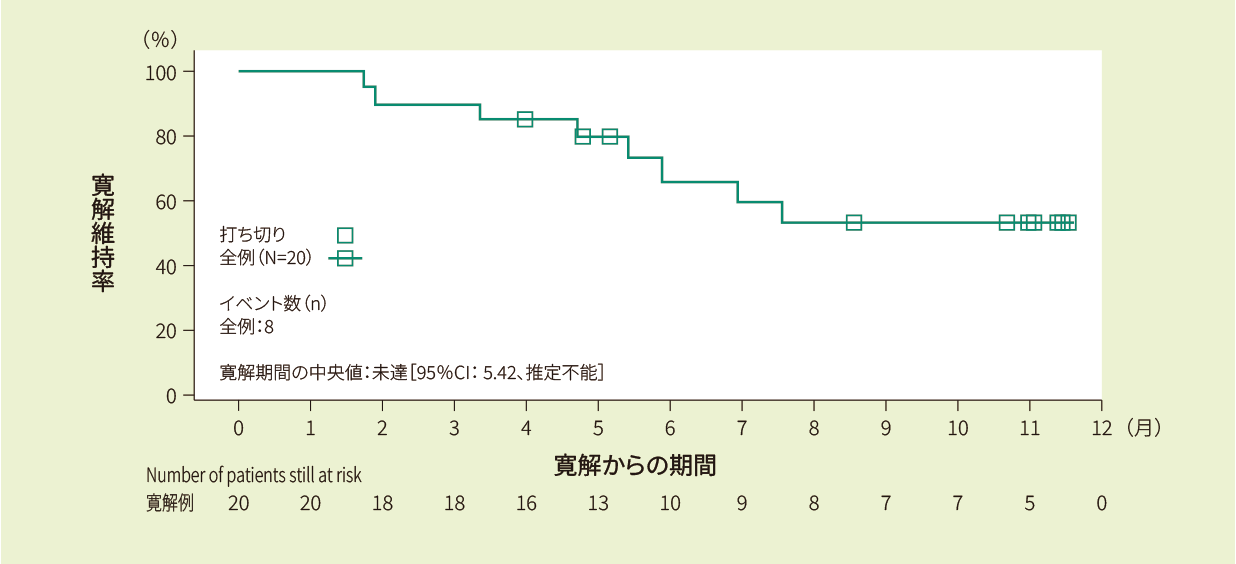
寛解例20例における6ヵ月時点の寛解維持率は66.4%であり、12ヵ月時点の寛解維持率及び寛解期間の中央値は推定できませんでした<副次評価項目>
Kaplan-Meier法で推定したIRC判定に基づく寛解期間の曲線(FAS)
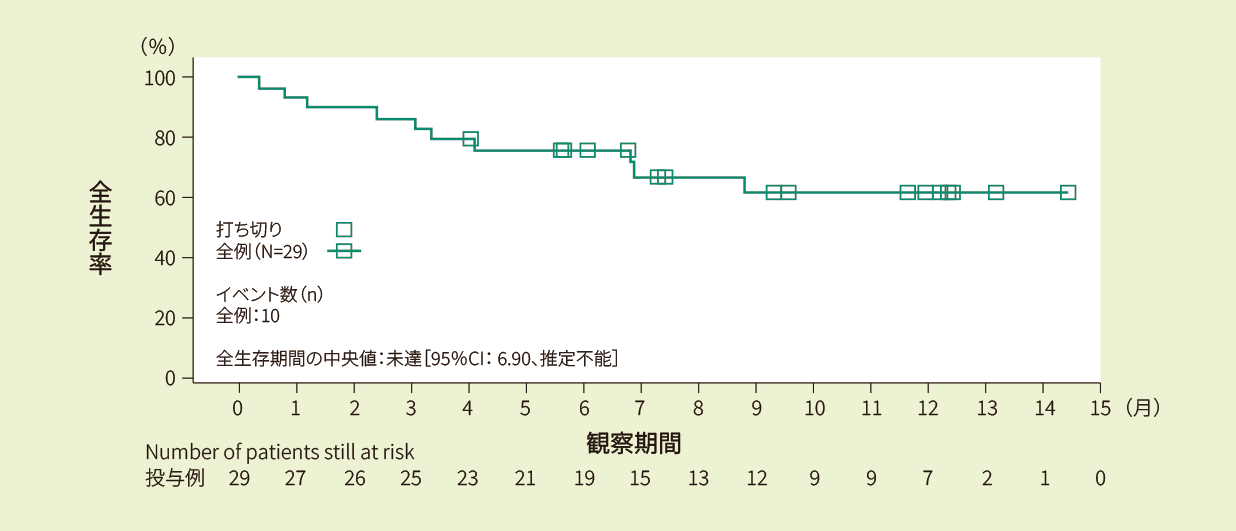
投与例29例における6ヵ月時点の全生存率は75.7%、12ヵ月時点の全生存率は61.7%であり、全生存期間の中央値は推定できませんでした<副次評価項目>
Kaplan-Meier法で推定した全生存期間の曲線(FAS)
安全性解析対象29例において、副作用は28例(96.6%)に認められました。高頻度(35%超)に認められた副作用は、サイトカイン放出症候群(CRS)26例(89.7%)、嘔吐13例(44.8%)、低γグロブリン血症12例(41.4%)、発熱、悪心、AST増加及び食欲減退 各11例(37.9%)でした。高頻度(5%超)に認められたグレード4の副作用は、CRS、低血圧及び好中球数減少 各6例(20.7%)、血小板数減少5例(17.2%)、AST増加及び白血球数減少 各4例(13.8%)、低酸素症、急性腎障害及び血小板減少症 各2例(6.9%)でした。
有害事象は29例全例で認められ、35%超に認められた有害事象は、CRS 26例(89.7%)、嘔吐15例(51.7%)、低γグロブリン血症、悪心、食欲減退及び発熱 各13例(44.8%)、ALT増加、貧血、AST増加、下痢及び低カリウム血症 各11例(37.9%)でした。
重篤な有害事象は23例(79.3%)に認められ、2例以上に認められた重篤な有害事象はCRS 20例(69.0%)、発熱性好中球減少症10例(34.5%)、低血圧4例(13.8%)、クロストリジウム・ディフィシレ大腸炎、低酸素症、発熱及び痙攣発作 各2例(6.9%)でした。このうち、CRS 20例(69.0%)、発熱性好中球減少症9例(31.0%)、低血圧4例(13.8%)、発熱及び低酸素症 各2例(6.9%)はキムリアとの関連ありと判断されました。
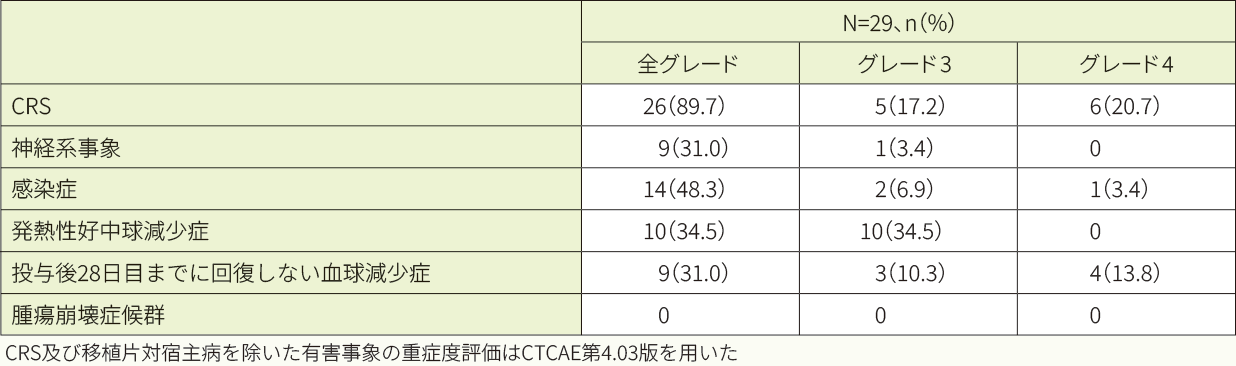
投与後8週以内で特に注意を要する有害事象は29例中26例(89.7%)に認められ、最も多く認められた有害事象はCRSが26例(89.7%)でした。CRSの発現までの期間の中央値は4日であり、CRSの持続期間の中央値は8.5日でした。CRSに対して実施した、主な抗サイトカイン療法はトシリズマブ(7例)、副腎皮質ステロイド剤(5例)の投与等であり、主な支持療法はICUへの入室(12例)、酸素吸入(9例)や高用量の昇圧剤(9例)の投与等でした。神経系事象の多くは、CRSが発現している間又はCRSから回復した直後に認められました。主な神経系事象は、錯乱状態(5例)、易刺激性(2例)、痙攣発作(2例)等でした。
キムリア投与後8週以内で特に注意を要する有害事象
投与後8週以内に試験中止に至った有害事象として塞栓性脳卒中が1例(3.4%)に認められました。
キムリア投与後30日以内の死亡は2例(6.9%、死因:疾患進行及び塞栓性脳卒中が各1例)に認められました。このうち、塞栓性脳卒中はリンパ球除去化学療法との関連ありと判断されましたが、キムリアとの関連は否定されました。投与後30日超の死亡は8例(27.6%)認められ、死因はすべて疾患進行でした。
- 【効能、効果又は性能】
-
1. 再発又は難治性のCD19陽性のB細胞性急性リンパ芽球性白血病。ただし、以下のいずれかの場合であって、CD19抗原を標的としたキメラ抗原受容体発現T細胞輸注療法の治療歴がない患者に限る。
・初発の患者では標準的な化学療法を2回以上施行したが寛解が得られない場合
・再発の患者では化学療法を1回以上施行したが寛解が得られない場合
・同種造血幹細胞移植の適応とならない又は同種造血幹細胞移植後に再発した場合
2. 再発又は難治性のびまん性大細胞型B細胞リンパ腫。ただし、以下のいずれかの場合であって、CD19抗原を標的としたキメラ抗原受容体発現T細胞輸注療法の治療歴がない、かつ、自家造血幹細胞移植の適応とならない又は自家造血幹細胞移植後に再発した患者に限る。
・ 初発の患者では化学療法を2回以上、再発の患者では再発後に化学療法を1回以上施行し、化学療法により完全奏効が得られなかった又は完全奏効が得られたが再発した場合
・ 濾胞性リンパ腫が形質転換した患者では通算2回以上の化学療法を施行し、形質転換後には化学療法を1回以上施行したが、形質転換後の化学療法により完全奏効が得られなかった又は完全奏効が得られたが再発した場合
《効能、効果又は性能に関連する使用上の注意》
1. 再発又は難治性のCD19陽性のB細胞性急性リンパ芽球性白血病
(1)25歳以下(投与時)の患者に使用すること。
(2)フローサイトメトリー法又は免疫組織染色法等により検査を行い、CD19抗原が陽性であることが確認された患者に使用すること。
(3) 臨床試験に組み入れられた患者の前治療歴等について、【臨床成績】の項の内容を熟知し、本品の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
2. 再発又は難治性のびまん性大細胞型B細胞リンパ腫
(1) 臨床試験に組み入れられた患者の組織型及び前治療歴等について、【臨床成績】の項の内容を熟知し、本品の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
- ALL:
- acute lymphoblastic leukemia;急性リンパ芽球性⽩⾎病
- B-ALL:
- acute B cell lymphoblastic leukemia;B細胞性急性リンパ芽球性⽩⾎病
- CAR:
- chimeric antigen receptor;キメラ抗原受容体
- CR:
- complete remission;完全寛解
- CRi:
- complete remission with incomplete blood count recovery;⾎球数回復が不十分な完全寛解
- CRS:
- cytokine release syndrome;サイトカイン放出症候群
- FAS:
- full analysis set;最⼤の解析集団
- HSCT:
- hematopoietic stem cell transplantation;造⾎幹細胞移植
- IRC:
- independent review committee;独⽴審査委員会
- MRD:
- minimal residual disease;微⼩残存病変
- ORR:
- overall remission rate;全寛解率
- Penn:
- University of Pennsylvania;ペンシルベニア⼤学
- TKI:
- tyrosine kinase inhibitor;チロシンキナーゼ阻害剤