びまん性大細胞型B細胞
リンパ腫(DLBCL)
RWE CIBMTR(海外データ、NHL*1 )
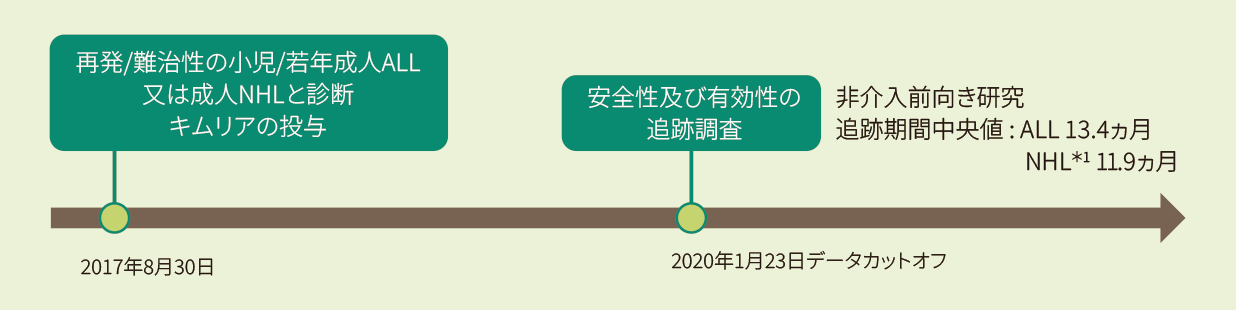
再発/難治性の小児/若年ALL又は成人NHL*1患者におけるキムリアの有効性及び安全性を評価する実臨床データ解析、非介入前向き研究
- *1 登録されている患者は国内承認範囲内の対象であった
- *2 データカットオフ日:2020年1月(追跡期間中央値:11.9ヵ月)
Limitation
患者集団等の違いにより、臨床試験と実臨床での成績を直接比較することはできません。
データ収集の違い(有効性評価のタイミング等)、キムリアによる治療は検討されたが投与を受けていない患者が含まれていないこと(治療や死亡、有害事象等による)、ブリッジング療法の確認が困難であること、B細胞形成不全のデータ又はCD19陰性再発に関連する情報がないこと。
Pasquini, MC. et al.:Blood Adv. 4(21), 5414, 2020 COI:本試験はノバルティスの資金により行われた。著者にノバルティスより謝礼、研究助成金を受領した者及び社員が含まれる。
試験デザイン
- 目的
-
実臨床でキムリアを投与された410例の患者を対象に、安全性と有効性の早期分析、及び転帰に関するパラメータの評価
- 対象
-
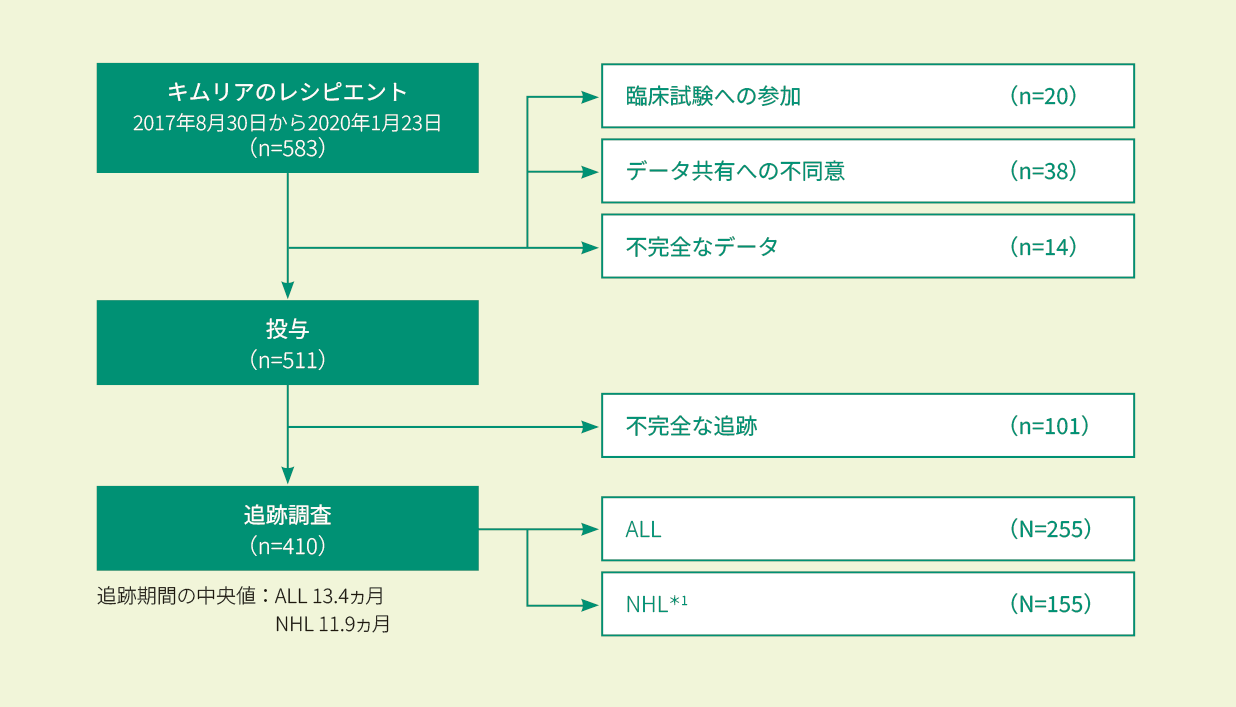
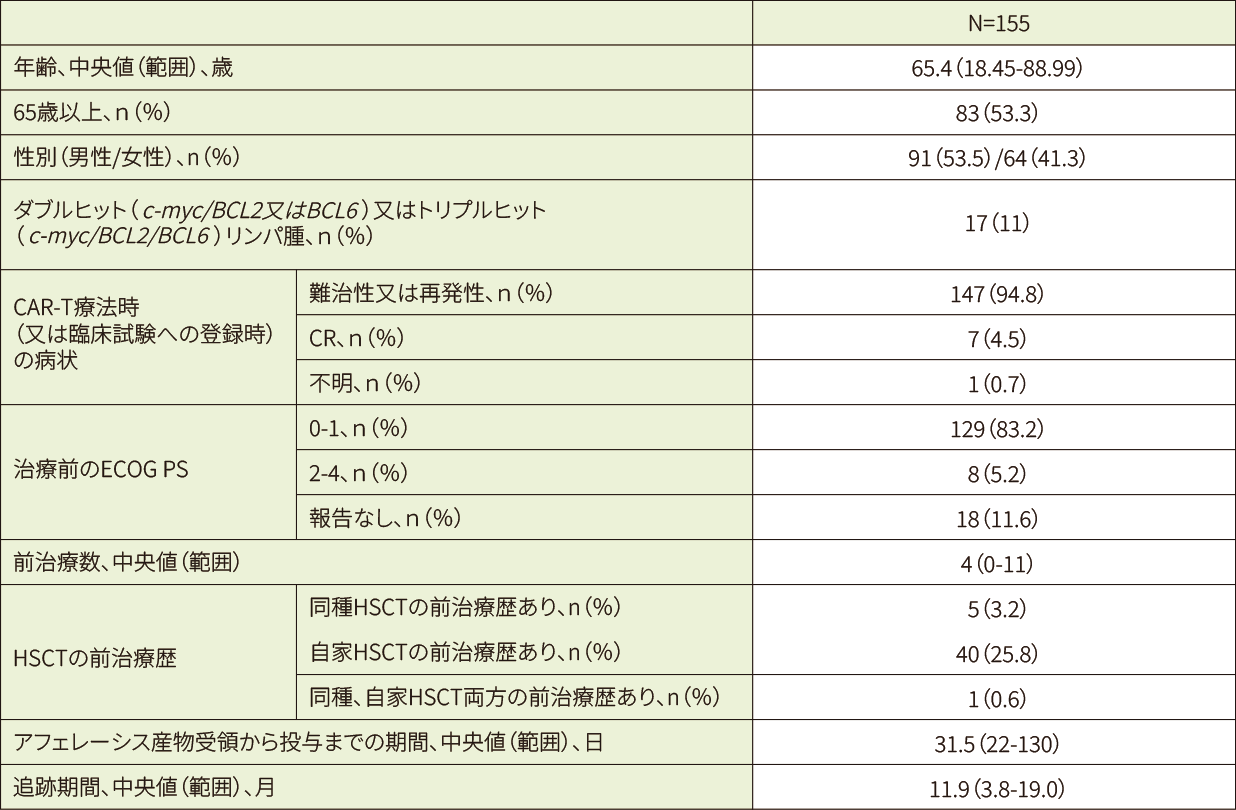
米国及びカナダで2017年8月30日(初回承認)以降に、再発/難治性の小児/若年成人ALL又は成人NHL*1と診断されキムリアが投与された患者(511例)のうちNHL*1患者155例
- 投与方法・投与量
-
CAR発現生T細胞として0.6×108~6.0×108個を体重に関係なく単回静脈内投与した。
- 評価項目・
解析計画 -
- 評価項目
-
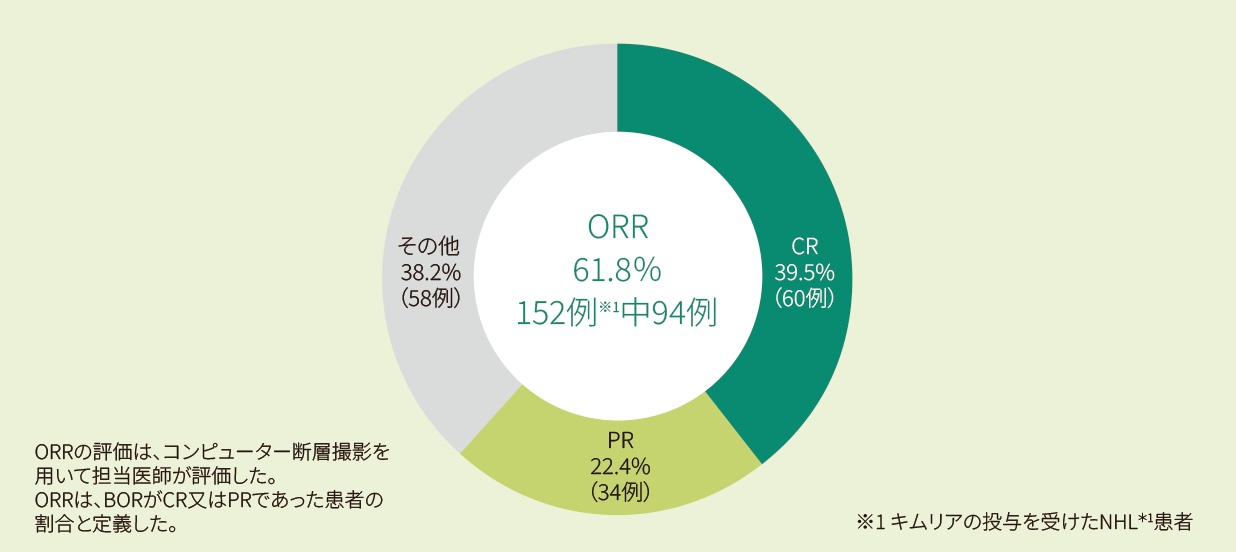
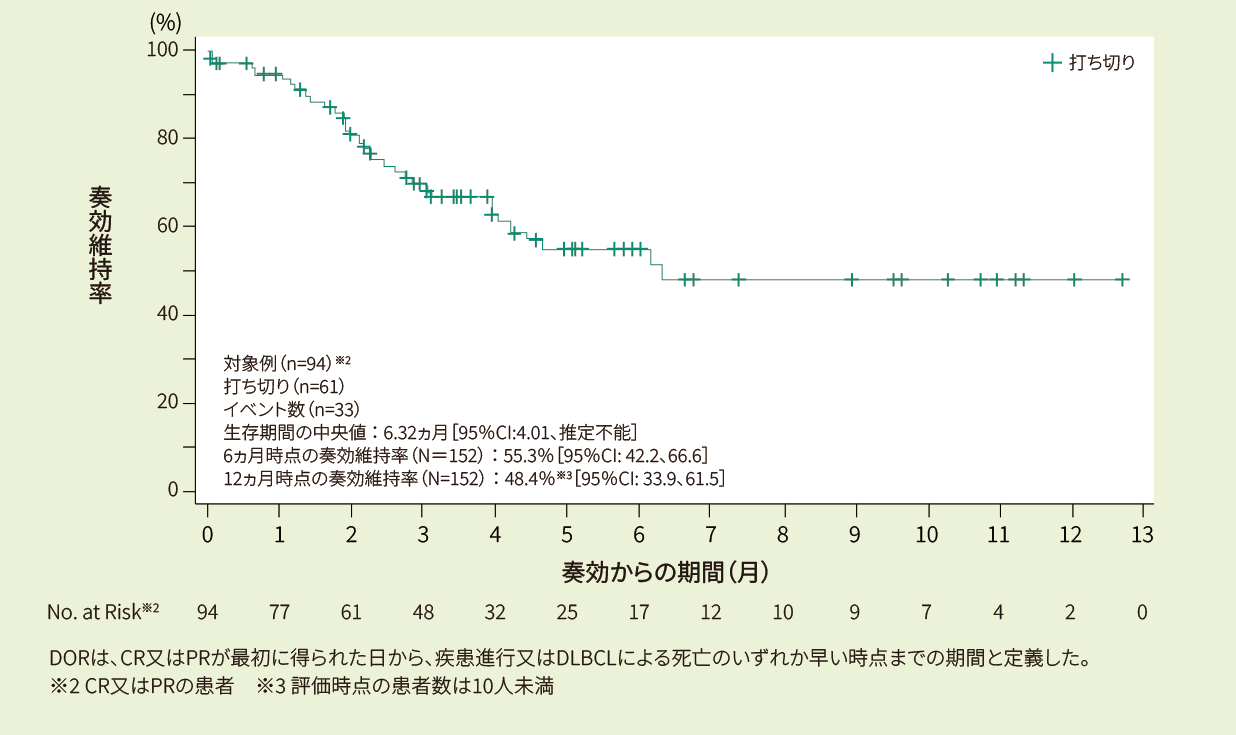
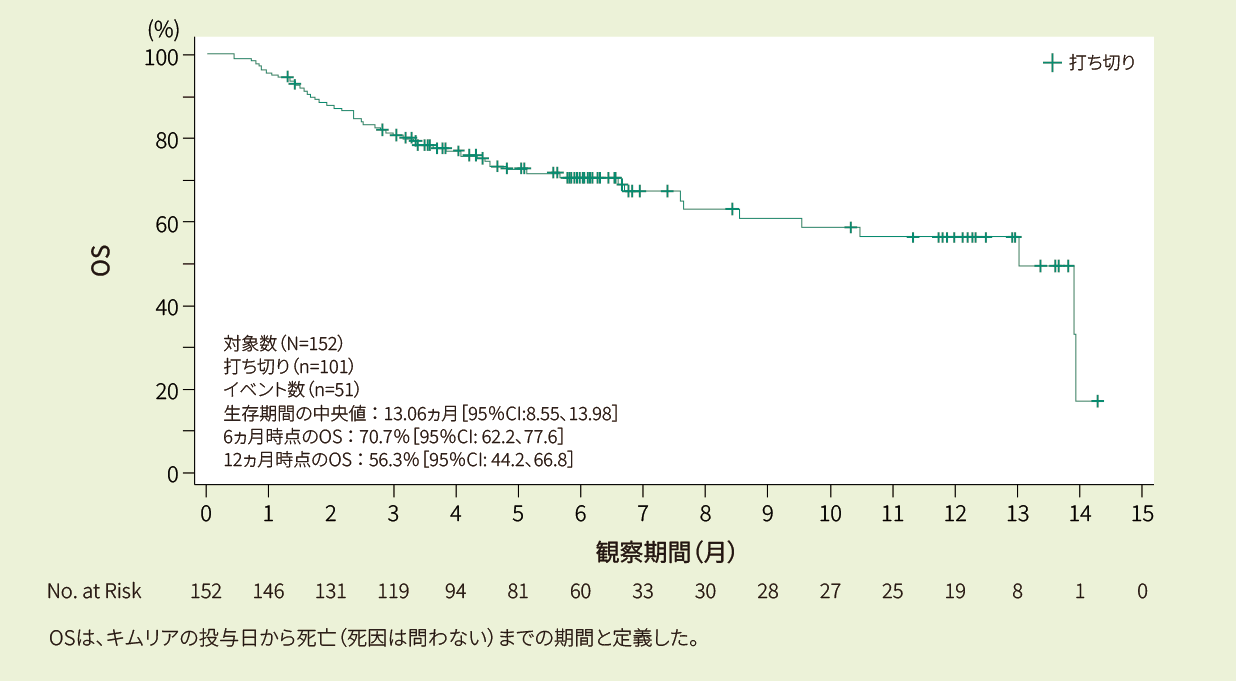
有効性:ORR、DOR、EFS、PFS、OS(疾患転帰に関する情報を持つ患者:401例のみ)
安全性:CRS、ICANS、二次性悪性腫瘍のがん種と頻度、血球減少からの回復(好中球及び血小板)
- コホート
-
CIBMTR(ウィスコンシン医科大学と全米骨髄ドナープログラム/BeMatchの共同研究)により運営されている細胞免疫療法データリソースに登録されたT細胞レシピエントであり、米国及びカナダの130施設から収集されたデータを元に、2020年1月時点で73施設、511例の患者が登録された。
解析にはキムリアの投与を行った患者とCT撮影後3ヵ月の経過観察が完了した患者のみを含めた(410例:全キムリア投与患者の70%)。
(研究登録は進行中のため、各データ凍結には追跡期間の異なる患者が含まれる)
- 解析計画
-
人口統計学と疾患特性を含む全患者のベースラインデータに記述統計を用いた。
初回投与後の安全性事象の数と割合を記述的に要約した。
適応症別のORR (BORとしてCR+PR)はキムリア投与後から病勢進行又は抗がん剤治療開始のいずれか早い時点としClopper-Pearson信頼区間(CI)と共に解析した。
DOR、PFS、EFS、OSはKaplan-Meier推定値を用いた。6ヵ月と12ヵ月での95%CIのEFSは、それぞれNHL*1に対し、リスク患者数に基づき決定した。
二次性悪性腫瘍は頻度と型を解析し、患者‐年当たりの発生率を計算した。
細胞生存率及び投与量と臨床的安全性エンドポイント(100日以内に発生した全グレードのCRS又はICANS)及びBORとの関係を、それぞれNHL*1患者に対してロジスティック回帰を用いて評価した。95%CIにおけるオッズ比は、細胞生存率の10%増加及び投与量の倍増に対してそれぞれ決定された。
潜在的な共変量の交絡因子である、キムリア投与時の疾患状態も評価した。
さらに、選択された臨床的有効性及び安全性エンドポイントを、細胞生存率80%未満又は80%以上の製品を投与された患者間で比較した。
データ解析にはSASソフトウェアパッケージを用いた。
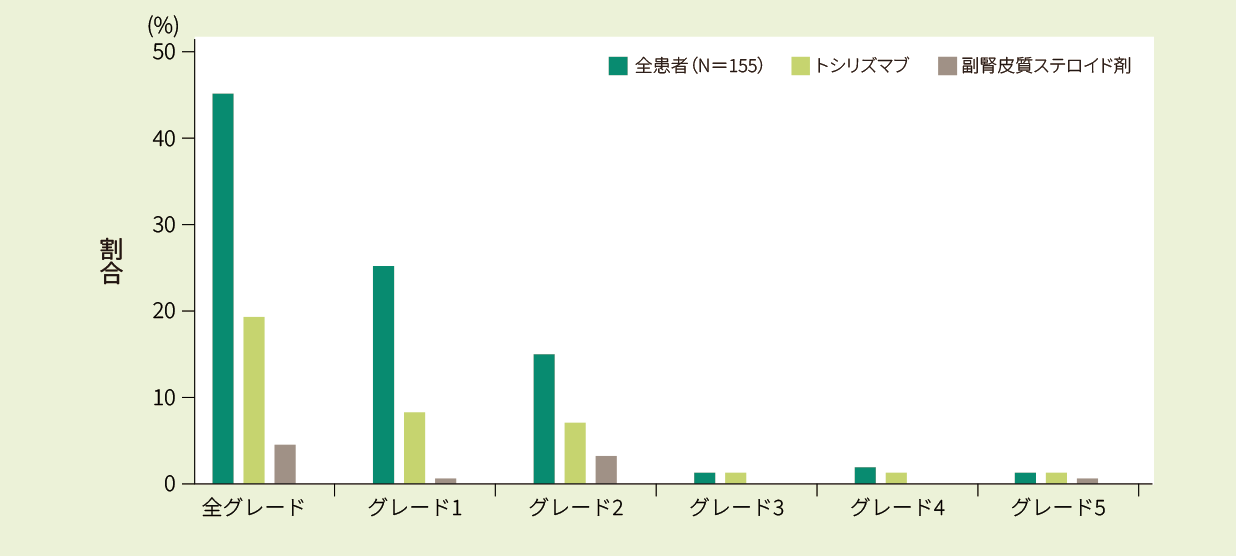
CRS※5が患者の70/155例(45.2%)に認められました。グレード3を超える重度のCRSは7/155例(4.5%)でした。うち2例は疾患進行の結果死亡し、CRSが寄与因子でした。
※5 CRSの評価は、ASTCTの基準を用いた。
キムリア投与後のNHL*1患者におけるCRS発生率及び治療薬使用率
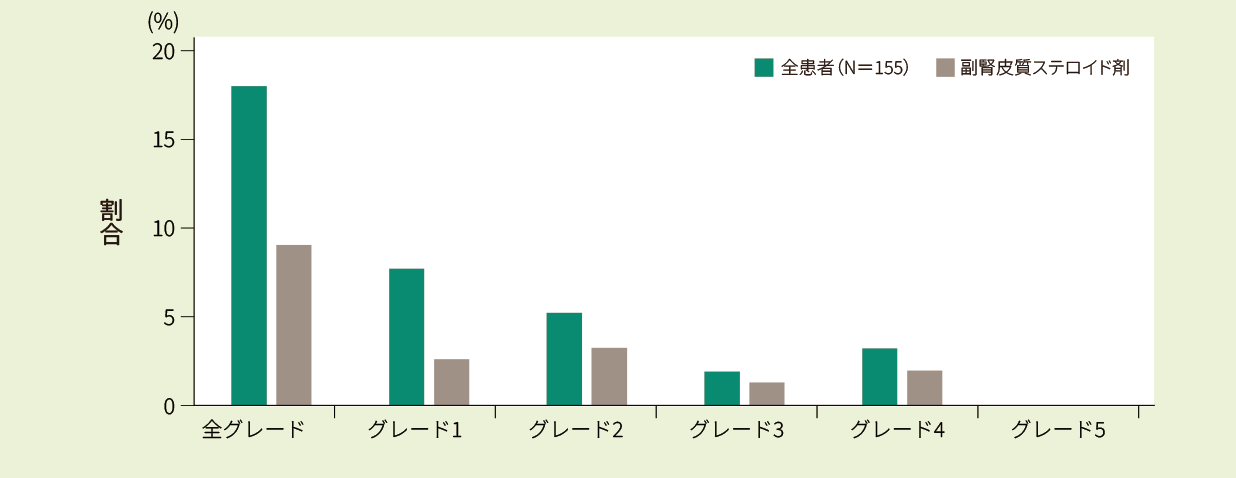
ICANS※6は、28/155例(18.1%)に認められました。主な症状は、意識低下(39.2%)と不全失語/失語(25%)でした。ダブルヒット又はトリプルヒットリンパ腫の患者及び65歳以上の患者でも同様の安全性が認められました。
※6 神経系事象の評価は、ASTCTの基準及びチサゲンレクルユーセル療法に関連する神経症状を用いた
キムリア投与後のNHL*1患者における神経系事象発生率及び治療薬使用率
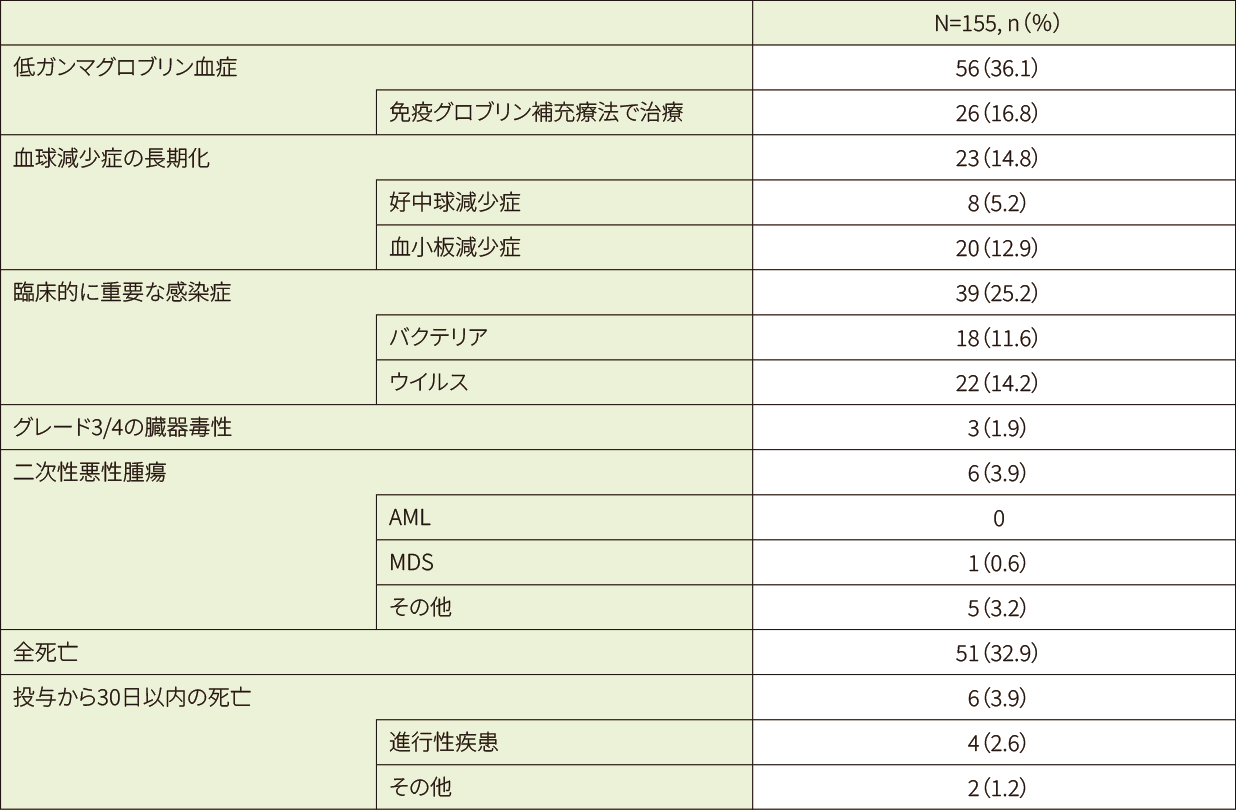
28及び100日目の好中球数回復の累積発生率は、それぞれ93%及び97%でした。同じく28及び100日目血小板数回復の累積発現率は、それぞれ86%及び89%でした。キムリア投与後30日目に、患者の5%及び13%に長期の好中球減少症と血小板減少症を認めました。
二次性悪性腫瘍が6例(3.9%)で報告され、内訳は基底細胞癌1例、泌尿生殖器系悪性腫瘍2例、MDS1例、B-ALL1例、胆管癌1例でした。投与後有害事象発生率は0.08件/100人/年でした。
NHL*1患者(155例)におけるCRS及びICANS以外の安全性エンドポイントの概要
- 【効能、効果又は性能】
-
1. 再発又は難治性のCD19陽性のB細胞性急性リンパ芽球性白血病。ただし、以下のいずれかの場合であって、CD19抗原を標的としたキメラ抗原受容体発現T細胞輸注療法の治療歴がない患者に限る。
・初発の患者では標準的な化学療法を2回以上施行したが寛解が得られない場合
・再発の患者では化学療法を1回以上施行したが寛解が得られない場合
・同種造血幹細胞移植の適応とならない又は同種造血幹細胞移植後に再発した場合
2. 再発又は難治性のびまん性大細胞型B細胞リンパ腫。ただし、以下のいずれかの場合であって、CD19抗原を標的としたキメラ抗原受容体発現T細胞輸注療法の治療歴がない、かつ、自家造血幹細胞移植の適応とならない又は自家造血幹細胞移植後に再発した患者に限る。
・ 初発の患者では化学療法を2回以上、再発の患者では再発後に化学療法を1回以上施行し、化学療法により完全奏効が得られなかった又は完全奏効が得られたが再発した場合
・ 濾胞性リンパ腫が形質転換した患者では通算2回以上の化学療法を施行し、形質転換後には化学療法を1回以上施行したが、形質転換後の化学療法により完全奏効が得られなかった又は完全奏効が得られたが再発した場合
《効能、効果又は性能に関連する使用上の注意》
1. 再発又は難治性のCD19陽性のB細胞性急性リンパ芽球性白血病
(1)25歳以下(投与時)の患者に使用すること。
(2)フローサイトメトリー法又は免疫組織染色法等により検査を行い、CD19抗原が陽性であることが確認された患者に使用すること。
(3)臨床試験に組み入れられた患者の前治療歴等について、【臨床成績】の項の内容を熟知し、本品の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
2. 再発又は難治性のびまん性大細胞型B細胞リンパ腫
(1)臨床試験に組み入れられた患者の組織型及び前治療歴等について、【臨床成績】の項の内容を熟知し、本品の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
- ALL:
- acute lymphoblastic leukemia;急性リンパ芽球性白血病
- ASTCT:
- 米国移植細胞治療学会
- BOR:
- best overall response;最良総合効果
- CAR:
- chimeric antigen receptor;キメラ抗原受容体
- CIBMTR:
- 国際造血細胞移植データ登録機構
- CNS:
- central nervous system;中枢神経系
- CR:
- complete response;完全奏効
- CRS:
- cytokine release syndrome;サイトカイン放出症候群
- DOR:
- duration of response;奏効期間
- DLBCL:
- diffuse large B-cell lymphoma;びまん性大細胞型B細胞リンパ腫
- EFS:
- event free survival;無イベント生存期間
- HSCT:
- hematopoietic stem cell transplantation;造血幹細胞移植
- ICANS:
- immune effector cell-associated neurotoxicity syndrome;免疫エフェクター細胞関連神経毒性症候群
- MDS:
- myelodysplastic syndromes:骨髄異形成症候群
- NHL:
- non-Hodgkin lymphoma;非ホジキンリンパ腫
- ORR:
- overall response rate;奏効率
- OS:
- overall survival;全生存期間
- PFS:
- progression free survival;無増悪生存期間
- PR:
- partial response;部分奏効
- RWE:
- リアルワールドエビデンス